Il mentolo, un alcol terpenico secondario
contenuto nell'olio essenziale di menta, ha oggi molteplici impieghi.
Come aroma, si utilizza nella preparazione di uno sciroppo da miscelare con acqua per ottenere una bevanda dissetante
e rinfrescante. Lo sciroppo è stato utilizzato anche per alleviare la nausea,
versandone alcune gocce su una zolletta di zucchero, da ingerire
successivamente.
Nei prodotti di primo soccorso, esso trova impiego per produrre un effetto criogenico - come sostituto del
ghiaccio vero, quando si opera in assenza di acqua e/o di elettricità.
Il mentolo rientra nella
formulazione di vari prodotti
farmaceutici: dai dentifrici ai balsamici, dagli antipiretici ai cerotti
applicati in diverse parti del corpo (es. sui piedi) per alleviare numerosi
disturbi (quest'ultimo uso è molto più frequente ed elaborato in Asia,
specialmente in Giappone).
La medicina orientale impiega il mentolo per trattare indigestione,
nausea, mal di gola, diarrea, raffreddore e mal di testa.
Alcuni sostenitori della teoria omeopatica ritengono che il
mentolo interferisca con gli effetti dei rimedi omeopatici. Il suo utilizzo è
fortemente sconsigliato per chi adotta cure omeopatiche, fino al punto di
vietare l'uso del dentifricio che lo contenga o che contenga l'estratto di
menta.
In chimica organica, il mentolo è utilizzato come ausiliario chirale in sintesi asimmetrica. Ad esempio, esteri
sulfinati (ottenuti dalla reazione di cloruri sulfinilici e mentolo) possono
essere usati per fare solfossidi enantiomericamente puri se trattati con
reagenti organolitio o reattivi di Grignard.
Il mentolo è utilizzato anche per
classica risoluzione di acidi carbossilici chirali, per formazione degli esteri
mentilici, separazione dei diastereoisomeri e successiva idrolisi ad alcol e
acido enantiopuro.
In profumeria, gli esteri mentilici sono utilizzati per
sottolineare le note floreali (soprattutto di rosa).
Il mentolo è ampiamente usato in
cosmetica, nel confezionamento di alcuni prodotti di bellezza.
PRODUZIONE INDUSTRIALE DEL MENTOLO
Il mentolo, che come si è visto è
assai presente nella formulazione di farmaci, cosmetici e come aroma in bevande
e alimenti, è oggi prodotto in generose quantità grazie al progresso della
chimica industriale.
Il processo Haarmann-Reimer è il più antico e muove da meta-cresolo e propilene: per alchilazione si ottiene il timolo, il quale è idrogenato a una miscela di isomeri del mentolo,
purificata poi per ottenere il prodotto voluto.
Il processo Takasago parte da mircene
e sfrutta un catalizzatore, ispirato a un composto studiato dal premio Nobel
giapponese Noyori. Esso, a un certo punto della sequenza di reazioni, permette
un'isomerizzazione dell'intermedio a citronellale, seguita da una ciclizzazione: il reagente (lineare) di
partenza, si chiude a formare l'anello dell'isopulegolo,
idrogenato poi a mentolo.
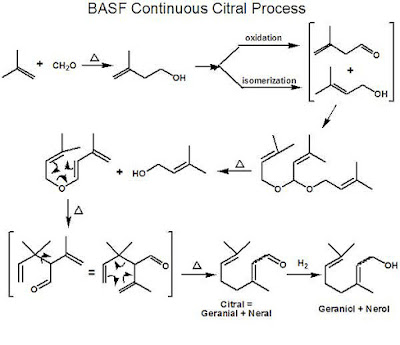
Nel giugno del 2010, la BASF annunciò che entro il 2012 avrebbe
completato la costruzione del più grande impianto al mondo per la sintesi del
mentolo a partire dal nerolo.
Il nerolo si ottiene purificando
il citrolo (una mistura di nerolo e
geraniolo); successivamente è idrogenato selettivamente in citronellolo, quindi
in isopulegolo e infine in mentolo.
Anche il geraniolo può essere trasformato in citronellolo e quindi in
isopulegolo e in mentolo, secondo quanto mostrato da Heydrich e altri nel 2009,
con l'impiego di un opportuno catalizzatore. Una reazione simile può essere condotta sulle rispettive aldeidi (schema 2): geraniale e neràle.
La cosa interessante è che il
catalizzatore che idrogena il neràle a citronellale è (semplificando) l'immagine speculare di quello che
idrogena il geraniale a citronellale: come dire, la mano destra lavora il
nerale e la mano sinistra lavora il geraniale, al fine di ottenere da entrambi
il citronellale (e quindi il citronellolo, l'isopulegolo e, alla fine, il mentolo). Tale catalizzatore è a base di rodio ed è modellato sul catalizzatore di Wilkinson, coordinato da un'opportuna fosfina chiamata Chirophos.